IMBRUVICA[much]新两项临床研究成功,有望扩大适应症IMBRUVICA[much]新两项临床研究成功,有望扩大适应症
![IMBRUVICA[much]新两项临床研究成功,有望扩大适应症](/images/upload/Image/20161207110549krn2ps.jpg)
在圣地亚哥举行的第58届美国血液学会(ASH)年会上,生物制药公司AbbVie公布了IMBRUVICA(ibrutinib)的两项[much]新临床研究的积极结果。
今天,AbbVie以口头报告形式公布了IMBRUVICA(ibrutinib)的2期临床研究PCYC-1129的[outstanding结果,在慢性移植物抗宿主病(cGVHD)患者中评估了其疗效。这些病人在干细胞或骨髓移植后呈现严重身体健康衰弱,经全身性治疗后失败。研究发现IMBRUVICA有效、产生持续性反应和减轻症状的严重程度,总体反应率(ORR)高达67%。IMBRUVICA是一种领域内一马当先Bruton酪氨酸激酶(BTK)抑制剂,由AbbVie公司旗下Pharmacyclics和Janssen Biotech公司联合开发和市场化。药明康德集团企业合全药业也参与协助了这款新药的合成。
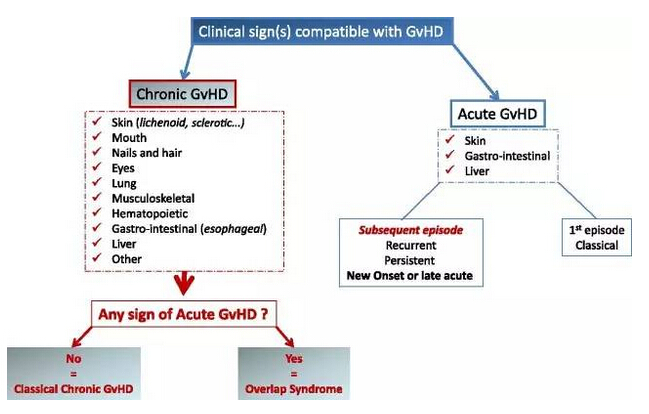
▲GVHD的临床分类(图片来源:《Blood》)
GVHD是一种危及生命的病症,由于患者经历同种异体干细胞或骨髓移植后,身体受到供体免疫细胞的攻击而发生。GVHD可以是急性或慢性的; 慢性GVHD(cGVHD)通常在移植后3个多月开始,并且可以持续许多年。症状可以包括皮肤问题、脱发、口腔溃烂、眼部刺激,严重肺损伤或肝功能障碍。针对那些一线糖皮质激素治疗失败后,仍然需要额外护理的cGVHD患者,目前尚未有获得批准的治疗方案。大多数cGVHD患者被给予高剂量的糖皮质激素处方治疗,这是一种抑制免疫系统并与其他并发症发病率和复发高度相关的全身性类固醇。
IMBRUVICA是一种口服型每日一次的治疗手段,可抑制一类被称为Bruton的酪氨酸激酶(BTK)蛋白质。BTK是B细胞受体信号转导复合物中的关键信号分子,在恶性B细胞的存活和扩散中起重要作用。IMBRUVICA可有效阻断恶性B细胞不可控繁殖和扩散的细胞信号,帮助杀死并降低癌细胞数量,延缓癌症的恶化。
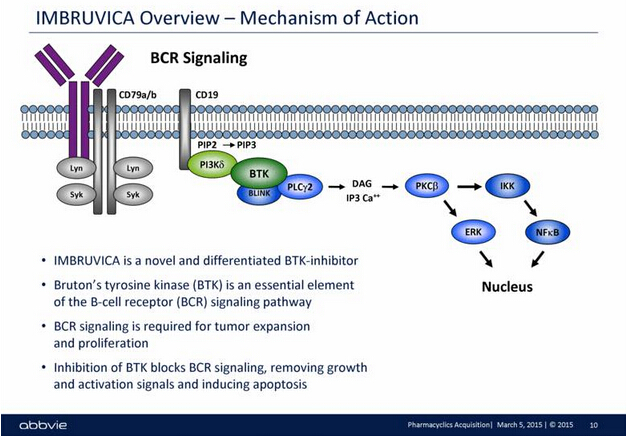
▲IMBRUVICA的作用机理(图片来源:SEC)
在美国,IMBRUVICA此前曾获批用于:复发性或难治性套细胞淋巴瘤(MCL)、经治慢性淋巴细胞白血病(CLL)、携带17p删除突变的CLL、Waldenstrom巨球蛋白血症(WM)。今年[much]新获批的适应症为一线治疗CLL和作为单药或联合苯达莫司汀+利妥昔单抗(BR)用于伴有或不伴有染色体17p删除突变(del 17p)的SLL患者。
PCYC-1129临床试验在42名cGVHD患者(中位年龄56岁)中评估了IMBRUVICA的安全性和功效,他们至少有过一种先前治疗失败(包括皮质类固醇)。患者每天使用IMBRUVICA,直到cGVHD进展或达到不可接受的毒性。主要终点是基于国立卫生研究院(NIH)共识标准而设定的cGVHD反应。次要终点包括持续反应率、Lee cGVHD症状量表、皮质类固醇需求随时间的变化和安全性终点的变化。
在42名患者中位随访14个月时,研究发现ORR为67%。所有反应者中有三分之一达到完全缓解(CR)。此外,71%的患者表现出至少5个月的持续反应。在所有相关的器官中都观察到相似的反应率,多器官移植的患者通常在多个器官中都有反应。 在研究过程中,61%的反应者有了临床意义上的症状改善,如通过LeecGVHD症状量表测量,评分至少降低7点。此外,62%的所有患者能够将类固醇剂量降低至可接受的低达水平。
昨天,AbbVie还公布了另外一项IMBRUVICA的2期有效性和安全性研究结果,数据表明近一半(48%)的复发/难治性(R/R)边缘区淋巴瘤(MZL)患者对IMBRUVICA单药具有完全或部分应答,结果是由独立审查委员会(IRC)研究者评估的。
MZL是在淋巴组织边缘处由白细胞(淋巴细胞)产生的缓慢生长的多样化非霍奇金淋巴瘤。MZL约在成年人中占所有非霍奇金淋巴瘤病例的12%,并且中位年龄诊断为65岁。针对MZL患者,目前还没有获得批准的治疗方案和治疗标准。
这个2期研究在R/R MZL患者中评估了IMBRUVICA的安全性和功效。试验的主要目的是衡量由IRC评估的ORR。反应持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性是次要目标。本研究的数据于2016年9月提交给美国FDA,作为补充新药申请(sNDA)的一部分,以扩大IMBRUVICA的现有适应症。
在该多中心、开放标记试验中,63名MZL患者(包括脾MZL、淋巴结MZL、和淋巴结外MZL亚型)接受一种或多种先前治疗,包括至少一种CD20-介导免疫治疗方案或利妥昔单抗治疗。在研究中,79%的患者经历了部分肿瘤减少(63个患者中的50个),总体反应率(ORR)为48%,这意味着BTK信号传导是MZL中的重要生长和存活因子。初始反应的中值时间为4.5个月。
我们衷心祝愿IMBRUVICA能够获得更广的适应症标签,造福更多的癌症患者群体。


